| 国家医疗器械不良事件监测年度报告 (2023年) |
| 发布日期:2024-10-24 点击数:2170 次 新闻来源:国家药品不良反应监测中心 |
为全面反映2023年我国医疗器械不良事件监测工作情况,国家药品不良反应监测中心编撰了《国家医疗器械不良事件监测年度报告(2023年)》。
一、医疗器械不良事件监测工作进展
2023年,我国医疗器械不良事件监测工作贯彻党的二十大和二十届二中全会精神,落实“四个最严”总体要求,严格按照《医疗器械不良事件监测和再评价管理办法》(以下简称《办法》)有关规定,持续完善制度体系建设,深入探索监测评价新方法,不断拓展宣传培训方式,全面提升风险预警和处置能力,为提高医疗器械监管水平、保障公众用械安全提供了强有力的技术支撑:
(一)持续夯实报告收集基础,不断扩大系统覆盖用户
2023年,国家医疗器械不良事件监测信息系统接收到医疗器械不良事件报告86万余份(不含错报误报),每百万人口平均报告数为615份。29个省(自治区、直辖市)的医疗器械不良事件报告县级覆盖率达到100%。医疗器械不良事件监测信息系统基层注册用户数量持续提升,达到41万余家,其中医疗器械注册人达34,711家。
(二)系统开展产品风险评价,稳步推进重点监测工作
2023年,全国医疗器械不良事件评价处置工作持续开展,系统运用日常监测、预警分析及季度汇总等手段,确保及时发现、评价并处置风险。对国外监管机构采取的风险控制措施进行监测,根据发现风险的情况,全年共发布12期《医疗器械警戒快讯》。
稳步推进重点监测工作,审核37个医疗器械品种不良事件重点监测2022年工作总结,开展重点监测工作实施情况调研,召开重点监测实施情况座谈会,组织医疗器械不良事件重点监测培训,进一步提高全国监测机构工作能力,保证重点监测工作高质量完成。
(三)有序推进警戒制度试点,深入开展专项课题研究
2023年3月,国家药监局启动医疗器械警戒试点工作。国家药品不良反应监测中心组织北京、江苏等8个省份开展警戒试点工作,撰写完成《医疗器械警戒质量管理规范》等8个技术指南文件初稿,下一步将不断完善技术指南文件并逐步推广实施。警戒试点工作推动我国医疗器械不良事件监测工作进入了医疗器械警戒时代,工作的主动性、风险信息收集的全面性进一步提升。
2023年,国家药品不良反应监测中心承担国家药品监管科学行动计划第二批重点项目的医疗器械警戒技术和方法研究、科技部重大专项研究,围绕新标准、新技术、新工具深入探索并取得丰硕成果,不断规范并提升医疗器械不良事件监测评价工作能力,服务医疗器械科学监管。
(四)广泛开展宣传培训,积极参与国际交流
2023年,国家药品不良反应监测中心积极丰富宣传培训方式,不断强化宣传培训效果,努力营造“安全用械,共享健康”的氛围。主办了“北京市医疗机构医疗器械不良事件监测法规宣讲会”,组织开展了“医疗器械安全使用科普云课堂”在线展播活动,举办医疗器械不良事件监测核心技术研修班,提高全社会对医疗器械风险的认识,保障广大群众的用械安全。
国家药品不良反应监测中心积极参加国际医疗器械监管机构论坛(IMDRF)相关会议,有序开展“国家监管机构报告(NCAR)”信息交换工作,持续跟踪“不良事件术语和编码(AET)”项目组工作进展,积极开展全球医疗器械法规协调会(GHWP)相关工作,促进医疗器械不良事件监测工作国际交流与合作。
二、全国医疗器械不良事件报告总体情况
(一)年度报告总体情况
1.全国医疗器械不良事件报告数量。2023年,国家医疗器械不良事件监测信息系统共收到医疗器械不良事件报告867,240份。
2.每百万人口平均报告数量。2023年,我国每百万人口平均医疗器械不良事件报告数为615份,比上年增加24.75%(图1)。
图1 2019-2023年全国每百万人口平均医疗器械不良事件报告数比较
(二)注册基层用户数量
截至2023年12月31日,在国家医疗器械不良事件监测信息系统中注册的基层用户(包括注册人和备案人(以下简称注册人)、经营企业和使用单位)共415,158家,比上年增长4.43%。其中注册人34,711家,比上年增长9.68%,占用户总数的8.36%;经营企业246,184家,比上年增长4.83%,占用户总数的59.30%;使用单位134,263家,比上年增长2.43%,占用户总数的32.34%(图2)。
图2 2023年国家医疗器械不良事件监测信息系统注册基层用户情况
注:《办法》要求注册人“应当注册为国家医疗器械不良事件监测信息系统用户,主动维护其用户信息,报告医疗器械不良事件”。国家和省级监测机构开展培训、检查等工作,督促注册人在系统注册并维护产品信息,这是注册人开展医疗器械风险评价落实主体责任的前提。
三、全国医疗器械不良事件报告统计分析
(一)按报告来源统计分析
2023年,国家药品不良反应监测中心收到的医疗器械不良事件报告中,使用单位上报775,173份,占报告总数的89.38%;注册人上报18,717份,占报告总数的2.16%;经营企业上报73,000份,占报告总数的8.42%;其他来源的报告350份,占报告总数的0.04%(图3)。
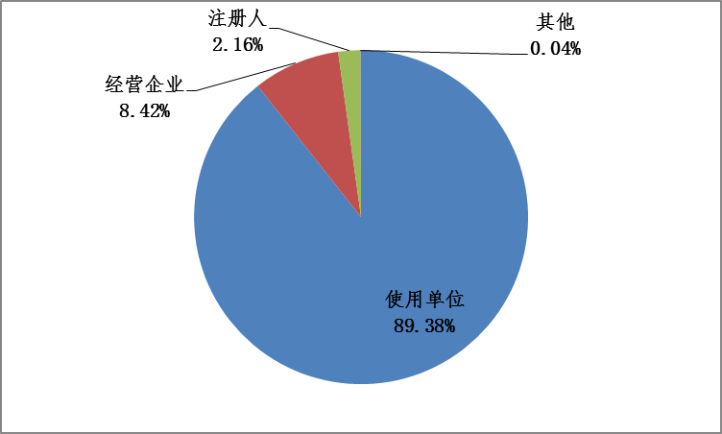 图3 2023年医疗器械不良事件报告来源情况
(二)按事件伤害程度统计分析
2023年,国家药品不良反应监测中心收到的医疗器械不良事件报告中,伤害程度为严重伤害及以上的报告65018份,占报告总数的7.50%;伤害程度为其他的报告802,222份,占报告总数的92.50%(图4)。
图4 2023年医疗器械不良事件报告涉及事件伤害程度情况
(三)按医疗器械管理类别统计分析
2023年,国家药品不良反应监测中心收到的医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告320,171份,占报告总数的36.92%;涉及Ⅱ类医疗器械的报告418,628份,占报告总数的48.27%;涉及Ⅰ类医疗器械的报告59,691份,占报告总数的6.88%;未填写医疗器械管理类别的报告68,750份,占报告总数的7.93%。(图5)。
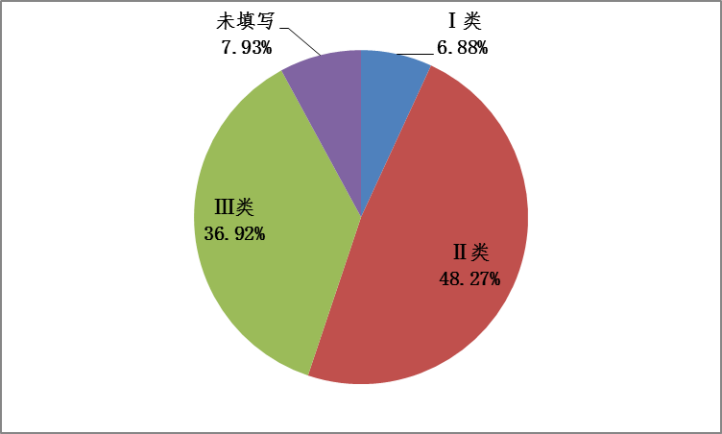
图5 2023年医疗器械不良事件报告涉及医疗器械管理类别情况

(四)按医疗器械分类目录统计分析
2023年,国家药品不良反应监测中心收到的医疗器械不良事件报告涉及了医疗器械分类目录中的所有类别。其中,报告数量排名前十位的医疗器械类别见表1。
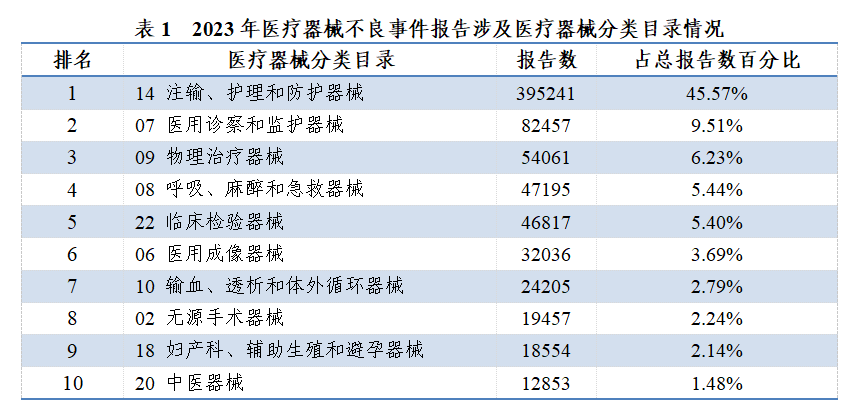

(五)按医疗器械结构特征统计分析
2023年,国家药品不良反应监测中心收到的医疗器械不良事件报告中,涉及有源医疗器械的报告235,307份,占报告总数的27.13%;涉及无源医疗器械的报告556,792份,占报告总数的64.20%;涉及体外诊断试剂的报告6,378份,占报告总数的0.74%;未填写医疗器械结构特征的报告68,763份,占报告总数的7.93%(图6)。
图6 2023年医疗器械不良事件报告涉及医疗器械结构特征情况
(六)按实际使用场所统计分析
2023年,国家药品不良反应监测中心收到的医疗器械不良事件报告中,使用场所为“医疗机构”的报告785,064份,占报告总数的90.52%;使用场所为“家庭”的报告67,112份,占报告总数的7.74%;使用场所为“其他”的报告15,064份,占报告总数的1.74%(图7)。
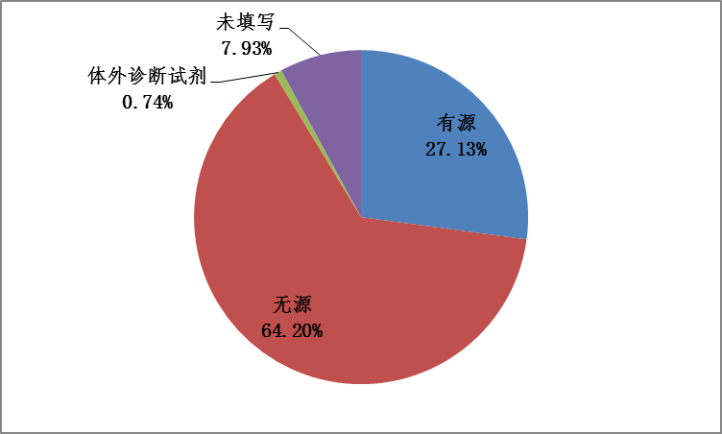
图7 2023年医疗器械不良事件报告涉及实际使用场所情况
四、医疗器械警戒快讯发布情况
2023年,国家药品不良反应监测中心密切跟踪全球医疗器械监管情况,发布12期《医疗器械警戒快讯》,汇总了美国、英国、澳大利亚以及加拿大发布的包括制氧机、呼吸机、血液透析导管、主动脉内球囊反搏泵等医疗器械在内的共81条安全性信息,为我国开展相关医疗器械的安全性评价和风险控制提供参考借鉴。
五、有关情况说明
(一)与大多数国家一样,我国医疗器械不良事件报告通过自发报告系统收集并录入到数据库中,即当怀疑某种事件可能与医疗器械有关时,就可以上报。受报告者主观意识、经验水平、认知程度、甚至所持立场等影响,医疗器械不良事件的报告可能存在片面性和局限性,如伤害程度判读不准确、报告填写不规范、信息不完善等,甚至将与医疗器械无关的事件也按照不良事件上报,因此统计结果可能与实际发生的医疗器械不良事件情况存在偏差。
(二)不同医疗器械的不良事件报告数量受使用数量、风险程度、报告意识等诸多因素影响,因此报告数量的多少不直接代表医疗器械不良事件发生率的高低或者风险严重程度。
(三)上述统计数据来源于国家医疗器械不良事件监测信息系统中2023年1月1日至2023年12月31日接收的数据,统计中由于四舍五入的进位规则,可能会出现百分比加和不等于100%的情况。
(四)本年度报告完成时,部分严重伤害医疗器械不良事件报告尚处在调查和评价的过程中,因此统计结果为统计时数据收集情况的真实反映,并不代表医疗器械安全性评价的最终结论。
小贴士
1.医疗器械:是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:
(1)疾病的诊断、预防、监护、治疗或者缓解;
(2)损伤的诊断、监护、治疗、缓解或者功能补偿;
(3)生理结构或者生理过程的检验、替代、调节或者支持;
(4)生命的支持或者维持;
(5)妊娠控制;
(6)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
2.医疗器械不良事件监测:是指对医疗器械不良事件的收集、报告、调查、分析、评价和控制的过程。
3.医疗器械不良事件:是指已上市的医疗器械,在正常使用情况下发生的、导致或者可能导致人体伤害的各种有害事件。
4.死亡医疗器械不良事件报告:指患者最终结果为死亡的医疗器械不良事件报告。不表示患者的死亡与使用医疗器械有明确的关联性。
5.医疗器械不良事件报告原则:报告医疗器械不良事件应当遵循可疑即报的原则,即怀疑某事件为医疗器械不良事件时,均可以作为医疗器械不良事件进行报告。报告内容应当真实、完整、准确。
导致或者可能导致严重伤害或者死亡的医疗器械不良事件应当报告;创新医疗器械在首个注册周期内,应当报告该产品的所有医疗器械不良事件。
6.国家医疗器械不良事件监测信息系统注册要求:注册人、经营企业和二级以上医疗机构应当注册为国家医疗器械不良事件监测信息系统用户,主动维护其用户信息,报告医疗器械不良事件。注册人应当持续跟踪和处理监测信息;产品注册信息发生变化的,应当在系统中立即更新。鼓励其他使用单位注册为国家医疗器械不良事件监测信息系统用户,报告医疗器械不良事件相关信息。
|
| 上一条:我国医疗器械标准数量突破2000项 | 下一条:国家药监局综合司公开征求《关于对药品、医疗器械质量安全内部举报人举报实施奖励的公告(征求意见稿)》意见 |